根据《中国药典》中对于药品杂质的定义,药品杂质包括有机杂质、无机杂质和残留溶剂,即所有影响药品纯度的物质均被称为杂质。
因此,无论是原研药还是仿制药企业,在药物的研发生产中均离不开对药品杂质的研究。
常见的杂质相关的专利申请包括如下两种情形:
▼ 情形一
申请日前现有技术中并未公开该杂质化合物,本发明首次发现该杂质化合物,旨在对该杂质化合物及其制备方法,或者仅对该杂质化合物的制备方法进行保护。
▼ 情形二
在申请日前该杂质化合物在现有技术中已公开,但现有技术中存在没有公开的合成工艺、合成工艺复杂、反应条件苛刻等原因,发明提供一种克服上述技术问题的新的制备方法。
在针对上述两种情形的杂质化合物的创新进行专利申请过程中,审查员对于杂质化合物的认定存在一定的争议。
经对历年结案的杂质相关专利检索分析发现,实质审查阶段审查意见通知书的意见包括不具备创造性(法22.3)、公开不充分(法26.4)、不具备实用性(法22.4),尤其是2022年开始,基于实用性(法22.4)驳回杂质相关专利的比例明显增加。
本文将结合一个经历了一波三折的复审案例分析情形一中杂质化合物的可专利性,以对后续该类主题专利申请过程提供参考。
【案例详情】
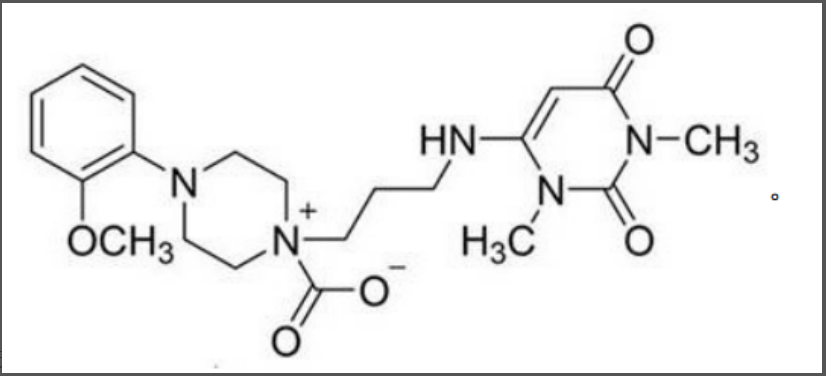
式I
第一次驳回
实审阶段以不符合专利法26.3款规定的公开充分为由驳回该专利。
具体理由为:
撤销驳回决定
申请人对上述驳回决定不服,提出了复审请求。
复审阶段,合议组认为专利符合公开充分的要求,撤销了上述驳回决定。
决定要点如下:
(1)对于化学产品发明,如果说明书公开了所述化学产品的确认和化学产品的制备,且本领域技术人员结合现有技术和本申请说明书记载的内容能够预期所述化学产品能够实现至少一种用途,那么说明书就满足公开充分的要求。
(2)药典明确了在诸如现代色谱技术的分析技术中杂质对照品的用途,也未否认提供杂质含量更低的高质量药品在产业上的意义。
因此,提供信号杂质含量低于0.1%以下的原料药或高纯度的信号杂质对照品是产业上基于生产成本和使用需要可以进行的选择。
(3)就本案而言,说明书附图4所示的制备工艺已被现有技术公开,说明书实施例4表明,在粗品中杂质I的含量超过0.1%面积,需经过提纯才能获得杂质I含量在0.1%面积以下的乌拉地尔精制品。
因此本领域技术人员有动机对乌拉地尔制品进行检测并控制其中杂质I的含量,在此基础上,式I杂质化合物是否具有毒副作用、提纯方法是否被现有技术公开并不影响对本申请说明书公开充分的判断。
第二次驳回
再次审查阶段,对该案件重新审查后认为该杂质化合物不具备专利法22.3的创造性,并最终以其不符合法22.3的规定驳回该专利。
驳回要点为:
在现有技术对比文件 1已公开了乌拉尔粗品制备工艺(与本发明附图4记载的制备工艺相同)的情况下,出于对产品质量检测的目的,本领域技术人员容易想到对粗产品进行纯度及杂质结构鉴定,当对对比文件1已公开的所述粗品进行产品分析时,容易通过常规分离鉴定和结构表征方法确定杂质的结构。
因此,出于对药品生产工艺杂质分析的普遍需求以及对已有合成路线的分析、鉴定,本领域技术人员容易获得所述乌拉尔杂质式I的结构。
由该案例可以看出:
01
对于已公开的药物制备过程1中产生的未明确其结构的杂质,在说明书中对其结构进行确认、公开其制备方法的情况下,记载其作为杂质对照品这一用途,即可满足专利法26.3公开充分的要求。
02
而且,结合合议组观点“根据药典的规定,提供杂质对照品以获得杂质含量更低的药品在产业上有其必要性,”可以得知,在说明书中充分记载对该已公开药物的杂质化合物的含量进行控制的情况下,杂质化合物具备专利法22.4规定的实用性。
03
关于杂质化合物专利申请的一些思考:
01
02
(1)对于“已公开药物的的制备过程”所述的药物,可以是已上市药物,也可能是未上市药物,现有文献已公开了该药物的制备工艺。
(2)可参考典型案例四环制药关于杂质化合物的专利CN201110006357.7保护一种杂质化合物,申请文件中考察了所述化合物的杀虫活性。














暂无评论内容